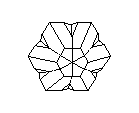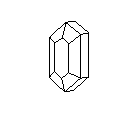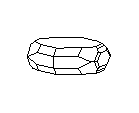
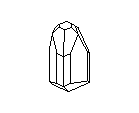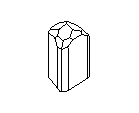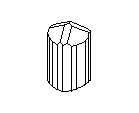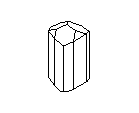
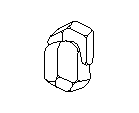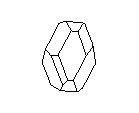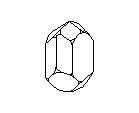АЛМАЗ И ГРАФИТ
Замечательным примером существования двух кристаллических разновидностей одного вещества являются кристаллы углерода. Если кристаллические решётки из атомов углерода построены одним способом, то они образуют прозрачные кристаллы алмаза, самого твёрдого из всех минералов на земле. Но если из тех же углеродных атомов построена несколько иная решётка, то получаются мелкие чёрные, совсем непрозрачные кристаллики графита - одного из самых мягких минералов. Алмаз - самый твёрдый, но отнюдь не самый прочный материал: его легко разбить молотком и совсем нетрудно просто сжечь; он сгорает в струе кислорода при 720° G. Наоборот, из графита делают огнеупорные сосуды, потому что он не горит даже при очень, высоких температурах. Удельный вес алмаза равен 3,5, а графита - 2,1. Графит проводит электричество, алмаз не проводит. Кристаллы алмаза хрупки, кристаллы графита гибки.
Казалось бы, что общего между ними?
Но химик скажет: между алмазом и графитом нет никакой разницы, и тот и другой - это чистый углерод. Почему же столь различны их свойства? Потому что атомы углерода образуют разные кристаллические структуры.
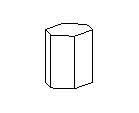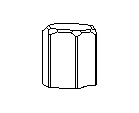
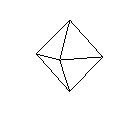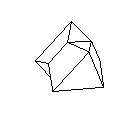
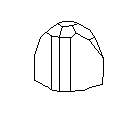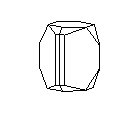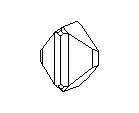
Посмотрите на кристаллическую решётку графита ( а,): она как бы разделена на этажи или слои. Если давить на кристалл графита, слои скользят и сдвигаются друг относительно друга, как карты в колоде. Вы, наверно, до сих пор не подозревали, что вам постоянно приходится сдвигать слои атомов углерода в кристаллической решётке графита? Это бывает всякий раз, когда вы пишете карандашом. Разглядите в лупу карандашную черту на бумаге: она состоит из мельчайших чешуек. Это - слои кристаллического графита. Конечно, в каждой чешуйке не один слой атомов, а много. Взгляните теперь на структуру алмаза ( б): не так уж сильно изменилось расположение атомов углерода, но слоев уже нет, и сдвинуть отдельный участок кристалла не удастся, поэтому алмаз намного-прочнее графита.

Интересно отметить, что при высокой температуре алмаз сравнительно легко переходит в графит. Но для техники это не нужно - зачем же превращать редкий драгоценный камень в дешёвый материал?
Следует особо предостеречь читателей
от ошибки, в которую иногда впадают,
рассматривая пространственную решетку
как действительную модель кристалла.
Решетка - это лишь условное
представление соединения ионов и атомов
в кристалле. Шарики в узлах решетки
условно обозначают атомы, а линии,
соединяющие их, так же условно
изображают силы связи. В
действительности расстояние между
атомами кристалла значительно меньше;
кристалл представляет собой плотную
упаковку составляющих его частиц .
Изображение атомов шарами условно. Шар
выбран только потому, что он очень
хорошо отражает свойства плотной
упаковки. В действительности же
происходит не просто соприкосновение, а
частичное взаимное перекрывание
областей отдельных атомов.
.
Изображение атомов шарами условно. Шар
выбран только потому, что он очень
хорошо отражает свойства плотной
упаковки. В действительности же
происходит не просто соприкосновение, а
частичное взаимное перекрывание
областей отдельных атомов.
В интересной популярной книге А.И.Китайгородского "Порядок и беспорядок в мире атомов" приведено такое удачное пояснение сказанного: "Напомним, что представление об атомах как о шарах, правильно отражая одно важное свойство - свойство плотно укладываться в плотные кристаллические упаковки, вовсе не исчерпывает сложнейшей природы атомов и не означает, что атомы - просто твердые шарики. Уподобление атома шарику означает по существу следующее: вокруг атома, как центра, мы мысленно проводим сферу такого радиуса, что основная часть электронов данного атома попадает внутрь сферы. Вот и получается шар, который служит, как говорят, моделью атома".
Противоположные электрические заряды, как известно, притягиваются. Когда два иона заряжены противоположно, между ними действуют электрические силы притяжения, являющиеся связующими силами в ионных кристаллах типа поваренной соли. Но если бы мы попытались сблизить два иона так, чтобы электронные орбиты ионов начали перекрываться, то начнут действовать силы отталкивания одноименных зарядов. Правильное пространственное распределение ионов в кристалле соответствует равновесия сил притяжения и отталкивания.
Если существование сил притяжения между ионами с противоположенными электрическими зарядами объясняет силы связи в ионных кристаллах, то как объяснить соединение одинаковых атомов в кристаллах, например, алмаза или графита? У соседних атомов в этих кристаллах появляются общие, так сказать, "коллективные" электроны, которые обращаются вокруг ядер обоих атомов.
Детальная теория сил при такой связи
сложна и относится к области квантовой механики.